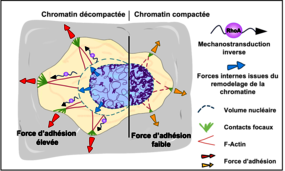
Dans le mécanisme de mécanotransduction classique, les cellules convertissent des signaux mécaniques en réponses biologiques, impliquant une série de relais mécaniques allant des protéines membranaires à la chromatine. En réponse à ces forces externes, la chromatine change de conformation pour contrôler l’activation ou la désactivation des gènes, ce qui détermine diverses fonctions cellulaires, comme la différenciation, l’adhésion ou la migration, Ce changement de conformation peut également induire des forces internes dans le noyau.
L’étude du laboratoire "Biomatériaux et Bioingénieries" (unité Inserm 1121/Unistra) est portée sur le rôle central de la chromatine comme régulateur mécanique et la transmission des forces nucléaires générées lors de son changement de conformation aux autres relais mécaniques dans le sens inverse, jusqu’à influencer l’adhésion cellulaire.
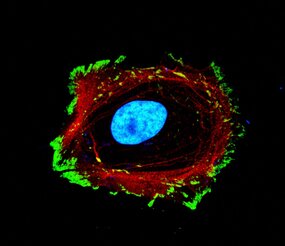
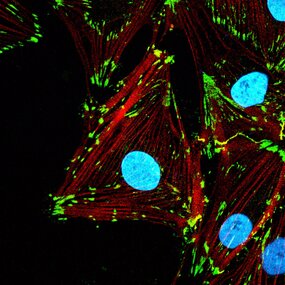
Les travaux de recherche menés par Morgane Rabineau, ingénieure de recherche, et de Julie Buisson, doctorante, ont démontré que le remodelage artificiel de la chromatine via des agents pharmacologiques (« remodeleurs ») influence directement la morphologie et l'adhésion cellulaire. En collaboration avec l'équipe du Prof. Tomaso Zambelli de l’ETH de Zurich, utilisant un microscope à force fluidique (FluidFM), les chercheurs ont démontré que la manipulation de la chromatine, régule la force d'adhésion des cellules. Lorsque la cellule est exposée à des remodeleurs compactant la chromatine, son volume nucléaire diminue, son cytosquelette se dé-structure et son adhésion à l'environnement diminue très fortement. Une fois le remodeleur retiré, la chromatine se décompacte, et la cellule retrouve sa force d’adhésion initiale sans avoir besoin de synthétiser de nouvelles protéines ; cela signifie que la cellule utilise les protéines déjà présentes pour restaurer les assemblages structurels, soulignant bien un relai mécanique allant de la chromatine aux protéines impliquées dans l’adhésion.
Ce phénomène, qualifié de "mécanotransduction inverse", souligne l'importance du rôle de la chromatine comme composant mécanique central régulant des fonctions cellulaires à elle seule, comme l’adhésion.
Cette avancée ouvre des nouvelles perspectives prometteuses pour le développement de biomatériaux et l'ingénierie tissulaire, permettant de manipuler la chromatine pour améliorer l'adhésion cellulaire et leur interaction avec l'environnement et les implants.
Les résultats de cette recherche sont publiés dans Nano Letters.
Retrouvez également un article sur le site de l'Inserm
Source : J Buisson et coll. Reverse mechanotransduction : driving chromatin compaction to decompaction increases cell adhesion strength and contractility. Nano Lett. 10 avril 2024 ; doi : 10.1021/acs.nanolett.4c00732
Contact : Morgane Rabineau, morgane.rabineau[at]inserm.fr
Source : Mittelheisser, V., Gensbittel, V., Bonati, L. et al. Evidence and therapeutic implications of biomechanically regulated immunosurveillance in cancer and other diseases. Nat. Nanotechnol. (2024). doi-org.proxy.insermbiblio.inist.fr/10.1038/s41565-023–01535‑8
Source : Mittelheisser, V., Gensbittel, V., Bonati, L. et al. Evidence and therapeutic implications of biomechanically regulated immunosurveillance in cancer and other diseases. Nat. Nanotechnol. (2024). doi-org.proxy.insermbiblio.inist.fr/10.1038/s41565-023–01535‑8
Source : Mittelheisser, V., Gensbittel, V., Bonati, L. et al. Evidence and therapeutic implications of biomechanically regulated immunosurveillance in cancer and other diseases. Nat. Nanotechnol. (2024). doi-org.proxy.insermbiblio.inist.fr/10.1038/s41565-023–01535‑8
Source : Mittelheisser, V., Gensbittel, V., Bonati, L. et al. Evidence and therapeutic implications of biomechanically regulated immunosurveillance in cancer and other diseases. Nat. Nanotechnol. (2024). doi-org.proxy.insermbiblio.inist.fr/10.1038/s41565-023–01535‑8
Source : Mittelheisser, V., Gensbittel, V., Bonati, L. et al. Evidence and therapeutic implications of biomechanically regulated immunosurveillance in cancer and other diseases. Nat. Nanotechnol. (2024). doi-org.proxy.insermbiblio.inist.fr/10.1038/s41565-023–01535‑8